บทที่ 1 แบบจำลองอะตอมและตารางธาตุ
อะตอม คือหน่วยที่เล็กที่สุดของสสารที่ยังคงสภาพความเป็นสสารอยู่ได้
แบบจำลองอะตอม ตามทฤษฏี มีอยู่ 5 แบบ คือ
1.แบบจำลองของดอลตัน
แบบจำลองอะตอมของจอร์น ดอลตัน
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม
เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
– อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
– อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
-อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอม
ของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูล
บางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน
ทรงกลมตันมีขนาดเล็กที่สุดซึ้งแบ่งแยกอีกไม่ได้
2. แบบจำลองของทอมสัน
แบบจำลองอะตอมของทอมสัน
ความรู้เกี่ยวกับสมบัติทางไฟฟ้าในสมัยโบราณเริ่มขึ้นเมื่อมนุษย์รู้จักนำแท่งอำพันมาถูกับผ้าขนสัตว์แล้วพบว่าแท่งนั้นสามารถดูดของเบาๆได้ นักปราชญ์ในสมัยคริสตศตวรรษที่สิบแปดอธิบายว่า สารทั้งปวงประกอบด้วยของไหลสองอย่าง คือ ไฟฟ้าลบและไฟฟ้าบวก หากเกิดการเสียดสีหรือถู สมบัติทางไฟฟ้าของสารจะปรากฏขึ้น เนื่องจากของไหลทั้งสองมีไม่เท่ากัน

การทดลองของ ครูกส์ กับหลอดรังสีแคโทด

วิลเลียมครูกส์(WilliamCrookes)ได้สร้างหลอดรังสีแคโทดขึ้นมาเพื่อทดลองการนำไฟฟ้าของก๊าซซึ่งเขาสรุปผลการทดลองได้ว่า “ก๊าซจะนำไฟฟ้าได้ดี เมื่อก๊าซนั้นมีความกดดันต่ำๆ และแรงเคลื่อนไฟฟ้ามีค่าสูงๆ”

การทดลองของ ครูกส์ กับหลอดรังสีแคโทด
ต่อมา เซอร์ โจเวฟ จอร์น ทอมสัน (SirJosephnJonhThomson)ได้ทำการทดลองเกี่ยวกับหลอดรังสีแคโทดเพิ่มเติมดังต่อไปนี้
การทดลองของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน ได้ทดลองเพิ่มเติม โดยดัดแปลงหลอดรังสีแคโทดใหม่ (ดังรูป)

เซอร์โจเซฟ จอห์น ทอมสัน ได้ทดลองเพิ่มเติม โดยดัดแปลงหลอดรังสีแคโทดใหม่ (ดังรูป)

ผลการทดลอง พบว่ามีจุดเรืองแสงหรือมีจุดสว่างบนฉากเรืองแสง
จากผลการทดลองทอมสันได้ตั้งสมมติฐานว่า จะต้องมีรังสีชนิดหนึ่งซึ่งมีประจุไฟฟ้าพุ่งเป็นเส้นตรงมาจากขั้วแคโทด มายังฉาก ซึ่งรังสีนี้อาจจะเกิดจากก๊าซที่บรรจุในหลอดแก้ว หรืออาจจะเกิดจากโลหะที่ทำเป็นขั้วแคโทด
เพื่อทดสอบสมมติฐานที่ว่าอะตอมประกอบด้วยอนุภาคที่มีประจุและต้องการจะทราบว่าเป็นประจุไฟฟ้าบวกหรือลบทอมสันจึงได้ทดลองต่อไปโดยใช้สนามไฟฟ้าเข้าช่วย โดยยึดหลักที่ว่า อนุภาคที่มีประจุไฟฟ้าจะต้องเบี่ยงเบนในสนามไฟฟ้า “ถ้าอนุภาคนั้นมีประจุไฟฟ้าบวกจะเบนเข้าหาขั้วลบของสนามไฟฟ้า และถ้ามีประจุลบจะเบนเข้าหาขั้วบวก”
โดยเพิ่มขั้วไฟฟ้าในหลอดรังสีแคโทด ดังรูป
จากผลการทดลองทอมสันได้ตั้งสมมติฐานว่า จะต้องมีรังสีชนิดหนึ่งซึ่งมีประจุไฟฟ้าพุ่งเป็นเส้นตรงมาจากขั้วแคโทด มายังฉาก ซึ่งรังสีนี้อาจจะเกิดจากก๊าซที่บรรจุในหลอดแก้ว หรืออาจจะเกิดจากโลหะที่ทำเป็นขั้วแคโทด
เพื่อทดสอบสมมติฐานที่ว่าอะตอมประกอบด้วยอนุภาคที่มีประจุและต้องการจะทราบว่าเป็นประจุไฟฟ้าบวกหรือลบทอมสันจึงได้ทดลองต่อไปโดยใช้สนามไฟฟ้าเข้าช่วย โดยยึดหลักที่ว่า อนุภาคที่มีประจุไฟฟ้าจะต้องเบี่ยงเบนในสนามไฟฟ้า “ถ้าอนุภาคนั้นมีประจุไฟฟ้าบวกจะเบนเข้าหาขั้วลบของสนามไฟฟ้า และถ้ามีประจุลบจะเบนเข้าหาขั้วบวก”
โดยเพิ่มขั้วไฟฟ้าในหลอดรังสีแคโทด ดังรูป

ผลการทดลองของทอมสัน
จากการทดลองพบว่า จุดสว่างบนฉากเรืองแสง เบนไปจากตำแหน่งเดิมโดยเบนเข้าหาขั้วบวกของสนามไฟฟ้า
ทอมสันสรุปว่า รังสีนั้นมีประจุไฟฟ้าและมีประจุไฟฟ้าเป็นลบเนื่องจากรังสีนี้เคลื่อนที่ออกจากขั้วแคโทดซึ่งเป็นขั้วลบ จึงเรียกรังสีชนิดนี้ว่า รังสีแคโทด และเรียกหลอดแก้วที่ใช้ทดลองว่า หลอดรังสีแคโทด
ทอมสัน ยังมีความสงสัยต่อไปว่า เกิดจากอะไร
การทดลองพิสูจน์สมมติฐานของทอมสัน
สมมติฐานที่ว่า อะตอมประกอบด้วยอนุภาคเล็กๆที่มีประจุไฟฟ้าเป็นลบแต่ไม่ทราบว่าอนุภาคลบเหล่านี้เกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้า
ทอมสันได้ศึกษาสมบัติของรังสีแคโทดต่อไป โดยหาอัตราส่วนระหว่างประจุต่อมวลของรังสีนั้น ในตอนแรกทอมสันได้ทดลองเปลี่ยนก๊าซชนิดต่างๆ ในหลอดรังสีแคโทด ผลการทดลองปรากฏผลเหมือนเดิม และเมื่อทดลองเปลี่ยนชนิดของขั้วไฟฟ้าที่ใช้ทำแคโทด ผลการทดลองปรากฏผลเหมือนเดิม และได้ค่าประจุต่อมวล(e/m)=1.7x108คูลอมบ์/กรัมเสมอไม่ว่าจะเปลี่ยนชนิดของการ หรือเปลี่ยนชนิดของโลหะที่ทำเป็นขั้วแคโทด
สรุปการทดลองของทอมสัน
ทอมสันทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้รังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสงเหมือนเดิม เมื่อคำนวณหาอัตราส่วนของประจุต่อมวล (e/m)ของอนุภาค จะได้ค่าคงที่ทุกครั้งเท่ากับ 1.76 x 108 คูลอมบ์ต่อกรัม
สรุปว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า อิเล็กตรอน
จากการทดลองพบว่า จุดสว่างบนฉากเรืองแสง เบนไปจากตำแหน่งเดิมโดยเบนเข้าหาขั้วบวกของสนามไฟฟ้า
ทอมสันสรุปว่า รังสีนั้นมีประจุไฟฟ้าและมีประจุไฟฟ้าเป็นลบเนื่องจากรังสีนี้เคลื่อนที่ออกจากขั้วแคโทดซึ่งเป็นขั้วลบ จึงเรียกรังสีชนิดนี้ว่า รังสีแคโทด และเรียกหลอดแก้วที่ใช้ทดลองว่า หลอดรังสีแคโทด
ทอมสัน ยังมีความสงสัยต่อไปว่า เกิดจากอะไร
การทดลองพิสูจน์สมมติฐานของทอมสัน
สมมติฐานที่ว่า อะตอมประกอบด้วยอนุภาคเล็กๆที่มีประจุไฟฟ้าเป็นลบแต่ไม่ทราบว่าอนุภาคลบเหล่านี้เกิดจากก๊าซในหลอดรังสีแคโทด หรือเกิดจากขั้วไฟฟ้า
ทอมสันได้ศึกษาสมบัติของรังสีแคโทดต่อไป โดยหาอัตราส่วนระหว่างประจุต่อมวลของรังสีนั้น ในตอนแรกทอมสันได้ทดลองเปลี่ยนก๊าซชนิดต่างๆ ในหลอดรังสีแคโทด ผลการทดลองปรากฏผลเหมือนเดิม และเมื่อทดลองเปลี่ยนชนิดของขั้วไฟฟ้าที่ใช้ทำแคโทด ผลการทดลองปรากฏผลเหมือนเดิม และได้ค่าประจุต่อมวล(e/m)=1.7x108คูลอมบ์/กรัมเสมอไม่ว่าจะเปลี่ยนชนิดของการ หรือเปลี่ยนชนิดของโลหะที่ทำเป็นขั้วแคโทด
สรุปการทดลองของทอมสัน
ทอมสันทำการทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซในหลอดรังสีแคโทด พบว่า ไม่ว่าจะใช้ก๊าซใดบรรจุในหลอดหรือใช้โลหะใดเป็นแคโทด จะได้รังสีที่ประกอบด้วยอนุภาคที่มีประจุลบพุ่งมาที่ฉากเรืองแสงเหมือนเดิม เมื่อคำนวณหาอัตราส่วนของประจุต่อมวล (e/m)ของอนุภาค จะได้ค่าคงที่ทุกครั้งเท่ากับ 1.76 x 108 คูลอมบ์ต่อกรัม
สรุปว่า อะตอมทุกชนิดมีอนุภาคที่มีประจุลบเป็นองค์ประกอบ เรียกว่า อิเล็กตรอน
ในค.ศ.1909เออาร์มิลลิแกนสามารถหาค่าประจุของอิเล็กตรอนได้โดยการทำการทดลองหยดน้ำมันซึ่งมีประจุภายใต้ความโน้มถ่วงของโลก

จากรูปพบว่าความต่างศักย์ที่เพิ่มขึ้นจะทำให้หยดน้ำมันที่มีประจุเคลื่อนที่ช้าลงเพราะถูกดึงดูดไว้ด้วยขั้วบวก และถ้าเพิ่มความต่างศักย์มากพอจนถึงค่าหนึ่ง จะทำให้หยดน้ำมันหยุดนิ่งได้ แสดงว่าแรงจากสนามไฟฟ้าและแรงเนื่องจากความโน้มถ่วงเท่ากันพอดี ถ้าเราทราบค่าความต่างศักย์และน้ำหนักของหยดน้ำมัน เราก็สามารถหาค่าประจุบนหยดน้ำมันได้ ซึ่งพบว่ามักมีค่าเป็นเลขจำนวนเต็มคูณกับค่าประจุที่เล็กที่สุดเสมอ (เป็นจำนวนเท่าของ 1.60x10-19 คูลอมบ์) เมื่อกำหนดค่าประจุของอิเล็กตรอนดังกล่าวและจากค่าอัตราส่วน(e/m)ของทอมสัน เราก็สามารถทราบได้ว่าน้ำหนักของอิเล็กตรอนคือ 9.11x10-31 ซึ่งปรากฎว่าเบากว่าอะตอมที่เบาที่สุด คือ ไฮโดรเจนราว 1/2000 เท่า
จากผลการทดลองเหล่านี้แสดงว่าอิเล็กตรอนในอะตอมเป็นหน่วยที่เล็กที่สุดและยังสนับสนุนว่าอิเล็กตรอนเป็นอนุภาคซึ่งแบ่งย่อยต่อไปไม่ได้อีกด้วย
การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป


ผลการทดลองของโกสไตน์ เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
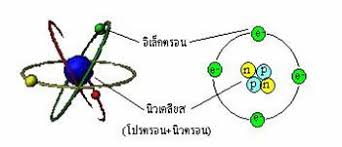
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้
อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซ
ไม่ได้เกิดจากขั้วไฟฟ้า
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้
อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ

แบบจำลองอะตอมตามทฤษฎีอะตอมของทอมสันมีลักษณะดังรูป
แบบจำลองนี้อธิบายสมบัติต่างๆของธาตุรวมทั้งทฤษฎีพันธะเคมีด้วย ซึ่งก็ใช้ได้บ้างในบางกรณี จนในปี ค.ศ. 1911 แบบจำลองนี้ก็ยกเลิกไป เมื่อ อี อาร์ รัทเธอร์ฟอร์ด ศึกษาการกระเจิง (scattering) ของรังสีแอลฟาในแผ่นโลหะบางๆแล้วพบว่าแบบจำลองอะตอมของทอมสันใช้อธิบายผลการทดลองไม่ได้
 4.แบบจำลองของนีลท์โบร์
4.แบบจำลองของนีลท์โบร์
นักวิทยาศาสตร์จึงมีการศึกษาข้อมูลใหม่มาสร้างแบบจำลองที่เน้นรายละเอียดเกี่ยวกับการจัดเรียงอิเล็กตรอนที่อยู่รอบนิวเคลียส โดยศึกษาจากสเปกตรัมและค่าพลังงานไอออไนเซชัน
3.แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
การกระเจิง (scattering) ของอนุภาค a โดยแผ่นทองคำบางๆ
รัทเทอร์ฟอร์ดพบว่ารังสีส่วนใหญ่ไม่เบี่ยงเบน และส่วนน้อยที่เบี่ยงเบนนั้น ทำมุมเบี่ยงเบนใหญ่มาก บางส่วนยังเบี่ยงเบนกลับทิศทางเดิมด้วย จำนวนรังสีที่เบี่ยงเบนจะมากขึ้นถ้าความหนาแน่นของแผ่นโลหะเพิ่มขึ้น
อนุภาคมูลฐาน
อนุภาค
|
ประจุ(หน่วย)
|
ประจุ(C)
|
มวล(g)
|
มวล(amu)
|
อิเล็กตรอน
|
-1
|
1.6 x 10-19
|
0.000549
|
9.1096 x 10-28
|
โปรตรอน
|
+1
|
1.6 x 10-19
|
1.007277
|
1.6726 x 10-24
|
นิวตรอน
|
0
|
0
|
1.008665
|
1.6749 x 10-24
|
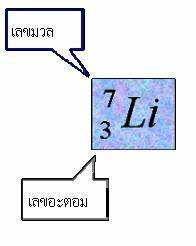
การเขียนสัญลักษณ์นิวเคลียร์
AZX : เลขมวล คือผลบวกของโปรตอน และนิวตรอนในนิวเคลียส
เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียส ซึ่ง =จำนวนอิเล็กตรอนในอะตอม
ตัวอย่าง การเขียนสัญลักษณ์นิวเคลียร์
ดังนั้น อะตอมของธาตุLithium ( Li ) มีจำนวนโปรตอน = 3 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
อิเล็กตรอน = 3 ตัว
และนิวตรอน = 4 ตัว
คำศัพท์ที่ควรทราบ
1. ไอโซโทป ( Isotope )
หมายถึง อะตอมของธาตุชนิดเดียวกัน มีเลขอะตอมเท่ากัน แต่มีเลขมวลต่างกัน
2. ไอโซบาร์ ( Isobar )
หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากัน แต่มีเลขอะตอมไม่เท่ากัน
3. ไอโซโทน ( Isotone )
หมายถึง อะตอมของธาตุต่างชนิดกันแต่มีจำนวนนิวตรอนเท่ากัน
นักวิทยาศาสตร์จึงมีการศึกษาข้อมูลใหม่มาสร้างแบบจำลองที่เน้นรายละเอียดเกี่ยวกับการจัดเรียงอิเล็กตรอนที่อยู่รอบนิวเคลียส โดยศึกษาจากสเปกตรัมและค่าพลังงานไอออไนเซชัน
สเปกตรัม
สเปกตรัมเป็นแสงที่ถูกแยกกระจายออกเป็นแถบสีต่าง ๆ และแสงเป็นรูปหนึ่งของคลื่นแม่เหล็กไฟฟ้า
แถบสีต่างๆในแถบสเปคตรัมของแสง
สเปกตรัม
|
ความยาวคลื่น (nm)
|
ม่วงน้ำเงินเขียวเหลืองส้มแดง
|
400 - 420420 - 490490 - 580580 - 590590 - 650650 - 700
|
สเปกตรัมของธาตุ
แมกซ์ พลังค์ได้เสนอทฤษฎีควอนตัม (quantum theory) และอธิบายเกี่ยวกับการเปล่งรังสีว่า รังสีแม่เหล็กไฟฟ้าที่เปล่งออกมามีลักษณะเป็นกลุ่มๆ ซึ่งประกอบด้วยหน่วยเล็กๆ เรียกว่า ควอนตัม (quantum) ขนาดของควอนตัมขึ้นกับความถี่ของรังสี และแต่ละควอนตัมมีพลังงาน (E) โดยที่ E เป็นปฏิภาคโดยตรงกับความถี่ (u) ดังนี้
E=hν
E = พลังงาน 1 ควอนตัมแสง(J)
h = ค่าคงที่ของพลังค์ (6.62x10-34 Js)
ν= ค่าความถี่ ( s-1)
5.แบบจำลองอะตอมกลุ่มหมอก
แบบจำลองอะตอมแบบกลุ่มหมอก
จากแบบจำลองอะตอมของโบร์ ไม่สามารถอธิบายสมบัติบางอย่างของธาตุที่มีหลายอิเล็กตรอนได้จึงมีการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาคการศึกษาเพิ่มเติมและเชื่อว่า อิเล็กตรอนมีสมบัติเป็นได้ทั้ง คลื่นและอนุภาค
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
สรุปแบบจำลองอะตอมแบบกลุ่มหมอกแบบจำลองนี้เชื่อว่า
1. อิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม แต่เคลื่อนที่ไปรอบๆนิวเคลียส
เป็นรูปทรงต่างๆตามระดับพลังงาน
2. ไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนไ้ด้ เนื่องจากอิเล็กตรอนมีขนาดเล็กมาก
และเคลื่อนที่รวดเร็วตลอดเวลาไปทั่วทั้งอะตอม
3. อะตอมประกอบด้วยกลุ่มหมอกของอิเล็กตรอนรอบนิวเคลียส บริเวณที่มีหมอกทึบ
แสดงว่ามีโอกาสพบอิเล็กตรอนได้มากกว่าบริเวณที่มีหมอกจาง ดังรูปที่แสดงไว้
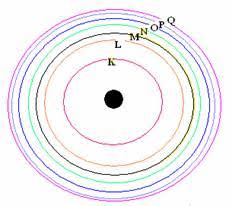
การจัดเรียงอิเล็กตรอน
ในแต่ละชั้นของระดับพลังงาน จะมีจำนวนอิเล็กตรอนได้ ไม่เกิน 2n 2
ระดับพลังงานหลัก
|
จำนวนอิเล็กตรอนที่มีได้มากที่สุด
|
n = 1 (K)
|
2(1) 2 = 2
|
n = 2 (L)
|
2(2) 2 = 8
|
n = 3 (M)
|
2(3) 2 = 18
|
n = 4 (N)
|
2(4) 2 = 32
|
n = 5 (O)
|
2(5) 2 =50
|
n = 6 (P)
|
2(6) 2 = 72
|
n = 7 (Q)
|
2(7) 2 = 98
|
ในแต่ละระดับชั้นพลังงาน จะมีระดับพลังงานชั้นย่อยได้ ไม่เกิน 4 ชั้นย่อย และมีชื่อเรียกชั้นย่อย ดังนี้ s , p , d , f
ระดับพลังงานชั้นย่อย s มี e - ได้ ไม่เกิน 2 ตัว ระดับพลังงานชั้นย่อย p มี e - ได้ ไม่เกิน 6 ตัว
ระดับพลังงานชั้นย่อย d มี e - ได้ ไม่เกิน 10 ตัว ระดับพลังงานชั้นย่อย f มี e - ได้ไม่เกิน 14 ตัว



วิธีการจัดเรียงอิเล็กตรอนในอะตอม

รูป จัดเรียงอิเล็กตรอนตามลูกศร
ตัวอย่าง
Br มีเลขอะตอม = 35 ดังนั้นการจัดเรียง e-ของธาตุ Br = 2 8 18 7

ตารางธาตุ
ตารางธาตุ (Periodic table)

พลังงานไอออไนเซชัน (IE)
พลังงานไอออไนเซชัน คือ พลังงานที่ใช้ในการดึงอิเล็กตรอน 1 อนุภาค ออกจากอะตอมในสถานะแก๊ส กลายเป็นไอออนบวก
ธาตุที่มีอิเล็กตรอน 1 ตัวคือ ธาตุไฮโดรเจน (H)
H(g) → H+(g) + e- IE=1,318 kJ/mol
อิเล็กโตรเนกาติวิตี (EN)
คือ ค่าที่แสดงความสามารถในการดึงอิเล็กตรอนของอะตอมของธาตุในพันธะเคมีหนึ่ง อะตอมที่มีค่า ENสูงจะดึงดูดอิเล็กตรอนได้ดีกว่าอะตอมที่มีค่า EN ตำ
อิเลกตรอนอัฟฟินิตี (EA) (สัมพรรคอิเล็กตรอน)
คือ ระดับพลังงานที่ใช้ในการดึงอิเล็กตรอนออกจากอิออนลบในสถานะก๊าช แล้วกลายเป็นอะตอมในสถานะก๊าช
Cl - (g) → Cl (g) + e ดูด
หรือพลังงานที่คายออกมา เมื่ออะตอมในสถานะก๊าชรับอิเล็กตรอน แล้วกลายเป็นอิออนในสถานะก๊าช
Cl (g) + e → Cl- (g) คาย
จุดหลอมเหลวและจุดเดือด (Melting point , Boiling point)
สารต่าง ๆ จะมีแรงยึดเหนี่ยวระหว่างอนุภาค ซึ่งขึ้นอยู่กับว่าสารนั้น ๆ อยู่ในรูปโมเลกุลหรืออะตอม ความแข็งแรงของแรงยึดเหนี่ยวระหว่างอนุภาคจะมีผลต่อจุดหลอมเหลวและจุดเดือด สารที่ที่มีแรงยึดเหนี่ยวระหว่างอนุภาคแข็งแรงมากจุดหลอมเหลวและจุดเดือดจะสูง ส่วนสารที่มีแรงยึดเหนี่ยวระหว่างอนุภาคแข็งแรงน้อย จุดหลอมเหลวและจุดเดือดจะต่ำ
1. แนวโน้มจุดหลอมเหลวและจุดเดือดตามคาบ
เมื่อพิจารณาตามคาบ ธาตุหมู่ IA IIA IIIA และ IVA จุดหลอมเหลวและจุดเดือดมีแนวโน้มสูงขึ้นตามลำดับ โดยเฉพาะหมู่ IVA จะมีจุดหลอมเหลวและจุดเดือดสูงที่สุด ส่วนหมู่ VA VIA VIIA และ VIIIA จุดหลอมเหลวและจุดเดือดต่ำ
2. แนวโน้มจุดหลอมเหลวและจุดเดือดตามหมู่
เมื่อพิจารณาตามหมู่พบว่าจุดหลอมเหลวและจุดเดือดของธาตุหมู่ IA IIA และ IIIA ส่วนใหญ่มีค่าลดลงเมื่อมีเลขอะตอมเพิ่มขึ้น หรือมีแนวโน้มลดลงจากบนลงล่างตามหมู่ เนื่องจากมีขนาดอะตอมใหญ่ขึ้น ความแข็งแรงของพันธะโลหะจะลดลงตามหมู่ ส่วนธาตุหมู่ VA VIA VIIA และ VIIIA มีจุดหลอมเหลวและจุดเดือดเพิ่มขึ้นตามเลขอะตอม ซึ่งเป็นผลมาจากมีมวลอะตอมเพิ่มขึ้น ทำให้แรงดึงดูดระหว่างโมเลกุล (แรงแวนเดอร์วาลส์) มีค่ามากขึ้น สำหรับจุดหลอมเหลวและจุดเดือดของธาตุหมู่ IVA มีแนวโน้มที่ไม่ชัดเจน เนื่องจากธาตุหมู่ IVA มีโครงสร้างและแรงยึดเหนี่ยวระหว่างอะตอมแตกต่างกัน จึงไม่สามารถสรุปแนวโน้มได้
เลขออกซิเดชัน (Oxidation number)
หมายถึงจำนวนประจุไฟฟ้าหรือประจุไฟฟ้าสมมติของไอออนหรืออะตอมของธาตุ
เกณฑ์การกำหนดค่าเลขออกซิเดชัน มีเกณฑ์ดังนี้
1.ธาตุอิสระทุกชนิดทั้งที่อยู่ในรูปอะตอมหรือโมเลกุล มีเลขออกซิเดชันเท่ากับศูนย์ เช่น Fe , Zn , H2 , N2 , O2 , P4 , S8 ต่างมีเลขออกซิเดชันเท่ากับศูนย์
2. ออกซิเจนในสารประกอบทั่วไปมีเลขออกซิเดชัน -2 ยกเว้นในสารประกอบเปอร์ออกไซด์ เช่น Na2O2 , H2O2 , BaO2 ออกซิเจนมีเลขออกซิเดชัน -1 ในสารประกอบซูเปอร์ออกไซด์ เช่น KO2 ออกซิเจนมีเลขออกซิเดชัน -1/2 ในสารประกอบ OF2 ออกซิเจนมีเลขออกซิเดชัน +2
3. ไฮโดรเจนในสารประกอบทั่วไปมีเลขออกซิเดชัน +1 ยกเว้นในสารประกอบโลหะไฮไดรด์ เช่น NaH ไฮโดรเจนมีเลขออกซิเดชัน -1
4. ไอออนของธาตุมีเลขออกซิเดชันเท่ากับประจุของไอออนนั้น เช่น H+ เลขออกซิเดชันเท่ากับ +1 , Ca2+ เลขออกซิเดชันเท่ากับ +2 , Cl- เลขออกซิเดชันเท่ากับ -1 เป็นต้น
5. ไอออนที่ประกอบด้วยอะตอมมากกว่า 1 ชนิด ผลรวมของเลขออกซิเดชันของทุกอะตอมเท่ากับประจุของไอออนนั้น เช่น Cr2O7 2- มีประจุ -2 ผลรวมของเลขออกซิเดชันของ Cr2O7 2- จึงเท่ากับ -2
6. ในสารประกอบใด ผลรวมของเลขออกซิเดชันของทุกอะตอมเท่ากับศูนย์ เช่น CaO เลขออกซิเดชันของแคลเซียมเท่ากับ +2 ของออกซิเจนเท่ากับ -2 ซึ่งรวมกันจะเท่ากับศูนย์
ตัวอย่างที่ จงหาเลขออกซิเดชันของ Mn ในสารประกอบ KMnO4
ผลรวมเลขออกซิเดชันของ KMnO4
|
=
|
0
|
K + Mn + 4(O)
|
=
|
0
|
(+1) + Mn + 4(-2)
|
=
|
0
|
Mn
|
=
|
(+8) - 1
|
=
|
+7
|



